染色体是遗传物质的载体。体细胞在分裂的间期将每一条染色体复制为一对姐妹染色单体,并在随后的有丝分裂期将其平均分配至两个子细胞中,从而保证了遗传物质的稳定传递。这个过程如果出错,就会导致子细胞染色体数目异常(即非整倍体),而非整倍体不仅是癌细胞的常见特征,还可以促进肿瘤的发生与发展。据估算,成人个体约由几十万亿个细胞组成,每天进行上万亿次细胞分裂。那么,人体内的细胞在无数次分裂过程中是如何确保染色体精确分离进而防止癌变的呢?这是个尚未完全解决的重要科学问题。
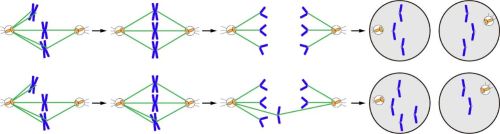
图1染色体正确分离(上)和错误分离(下)示意图(染色体、动粒和纺锤体微管分别显示为蓝色、灰色和绿色)
如图1所示,在细胞有丝分裂期,来自纺锤体两极的微管像“抓手”一样分别与姐妹染色单体上的超大蛋白复合体----动粒相连,牵引染色体向细胞赤道板整列,并随着细胞分裂将姐妹染色单体分别拉向细胞的两极,从而保证两个子细胞各获得一份完整的染色体拷贝,避免非整倍体的产生。因此,纺锤体微管与染色体动粒的正确连接是染色体正确整列和分离的根本前提。蛋白激酶Plk1是有丝分裂的重要调控因子,抑制其激酶活性会破坏微管与动粒间的稳定连接,进而影响染色体正常整列和分离。在染色体整列过程中,Plk1在动粒区有明显的富集,但其背后的分子机制和确切功能尚不清楚。此外,Plk1在许多恶性肿瘤中过高表达,并与不良预后相关。抑制Plk1的激酶活性可以阻止细胞分裂进而导致癌细胞凋亡,这使得Plk1成为抗癌药物研发的重要靶点。然而,Plk1激酶抑制剂在临床三期试验中表现不佳,尚未被正式用于癌症治疗。究其原因,可能与Plk1对于正常细胞分裂的必需性有关。
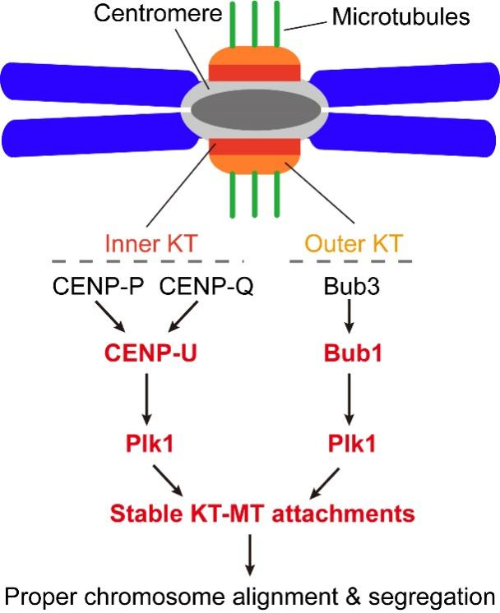
医学院衰老与肿瘤研究中心颜海燕博士团队研究发现(如图2所示),纺锤体检查点蛋白Bub1和动粒蛋白CENP-U可以独立地将Plk1分别招募至动粒的外层和内层,说明Plk1在动粒区有两条平行的招募通路。有意思的是,破坏这两条招募通路中的任何一条,并不会明显影响染色体整列和分离,只有当这两条通路同时被抑制时,染色体整列才会出现明显缺陷,说明Bub1招募的Plk1和CENP-U招募的Plk1在功能上是冗余的。进一步的机理研究发现,同时抑制Bub1和CENP-U对Plk1的招募时,纺锤体微管与染色体动粒不能稳定连接,说明Bub1和CENP-U所招募的Plk1通过稳定微管与动粒的连接促进染色体整列。非常有意思的是,抑制这两条招募通路中的任何一条,会使得细胞增殖对于Plk1激酶抑制剂变得尤为敏感,即低剂量(约常规剂量的十分之一)的Plk1激酶抑制剂便可显著抑制Bub1或CENP-U缺失细胞的增殖,而不明显影响对照组野生型细胞的增殖,这为降低Plk1抑制剂对正常细胞的毒性提供了新的策略。
图2 CENP-U和Bub1通过招募Plk1调控染色体整列和分离
这项以研究长文(ResearchArticle)形式发表于国际著名学术期刊《CellReports》的创新性研究成果,不仅揭示了蛋白激酶Plk1在动粒区定位的分子基础和功能,解析了染色体分离的重要调控机制,也为靶向Plk1激酶的癌症治疗提供了新的理论基础。在下一步的研究计划中,颜海燕团队将以筛选获得的Bub1或CENP-U低表达的肿瘤细胞系为基础,研发靶向抑制Bub1和CENP-U在动粒区定位的小分子化合物,并将其用于抑制癌细胞的增殖,进而推动Bub1和CENP-U基因突变相关癌症的精准治疗。
这项研究受国家自然科学基金、浙江省自然科学基金和国家重点研发计划资助,颜海燕为论文的通讯作者,陈亲富、张妙和潘璇为共同第一作者,浙江大学汪方炜教授为共同通讯作者,浙大城市学院医学院曾玲晖教授等为共同作者。
图/文:颜海燕、冯琳迤