2021年6月9日,浙大城市学院医学院潘建平教授课题组在《Nature Communications》发表研究论文“TcpC inhibits neutrophil extracellular trap formation by enhancing ubiquitination mediated degradation of peptidylarginine deiminase 4”,阐明尿路致病性大肠埃希菌(UPEC)毒力因子TcpC对中性粒细胞胞外捕捉陷阱形成(NETosis)的影响及其分子机制,揭示了UPEC逃逸中性粒细胞固有免疫功能新机制。

尿路感染(urinary tract infection, UTI)是最常见的感染性疾病之一,包括尿道炎、膀胱炎、肾盂肾炎等,每年约1.5亿人罹患UTI。大肠埃希菌(E. coli)是尿路感染最常见的病原体,约80%的UTI由E. coli引起。TcpC是UPEC产生的一种含有TIR结构域的毒力因子,2008年由德国微生物学家Thomas Miethke教授课题组发现,因其含有TIR结构域,可与TLR竞争结合MyD88,阻断TLR信号通路,抑制巨噬细胞活化和吞噬杀菌功能(Cirl C, et al. Nat Med 2008)。本课题组2021年3月31日在PLoS Pathogens发表论文,证明TcpC是一种能促进MyD88泛素化修饰的E3泛素连接酶,通过促进MyD88在蛋白酶体的降解,抑制TLR信号通路,揭示了TcpC介导UPEC逃逸机体固有免疫应答的新机制。这也是病原菌来源的毒力因子发挥E3泛素连接酶功能,促进MyD88降解的首次报道。
中性粒细胞胞外捕捉陷阱(neutrophil extracellular traps,NETs)是中性粒细胞发挥抗感染作用的关键机制,NETs形成过程称为NETosis。机体受病原微生物感染时,中性粒细胞可以通过NETosis捕捉病原体,然后利用附着在三维网状骨架上的抗菌蛋白杀死病原微生物。在NETsosi过程中,肽基精氨酸脱亚胺酶4(PAD4)催化组蛋白瓜氨酸化引起的熵变,是细胞核膜破裂的关键步骤,被认为是NETosis的分子开关。
急性UTI特征性病理变化是大量中性粒细胞浸润,本研究表明,TcpC主要通过其E3泛素连接酶活性,促进PAD4泛素化降解,从而抑制NETosis(图1)。本发现不仅揭示了UPEC逃逸中性粒细胞固有免疫功能的新机制,而且也为阐明其他病原菌的致病性提供了新的线索。
硕士生欧茜、博士后方佳琪和本科生张哲晟为论文共同第一作者,潘建平教授为论文通讯作者。
本研究受到了国家自然科学基金面上项目、中国博士后科学基金面上项目、浙江省自然科学基金和浙江省基础公益研究计划项目的资助。
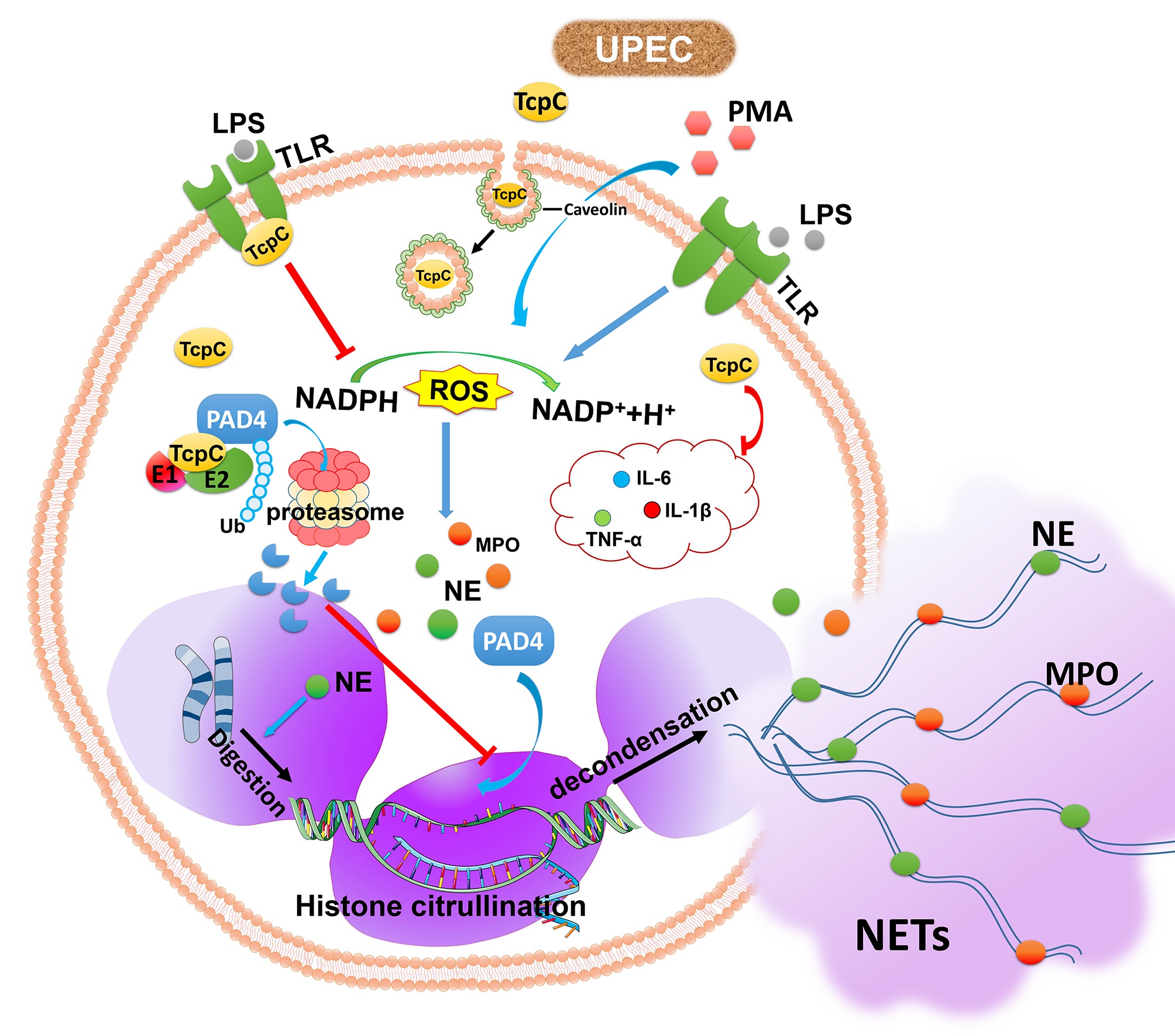
图1. TcpC抑制NETosis分子机制示意图
潘建平教授简介:
潘建平,男,1962年8月出生,医学博士,浙江大学医学院免疫学教授、博士研究生导师,主要从事感染免疫和肿瘤免疫研究,2007年1月~2012年1月任浙江大学医学院病原生物学系副主任。2012年2月~2019年8月,先后担任浙江大学城市学院医学院临床医学系主任、医学院副院长。现任中国免疫学会理事,浙大城市学院转化医学研究所所长,浙江省免疫学会常务理事、感染免疫专业委员会主任委员,浙江省抗癌协会肿瘤生物治疗专业委员会副主任委员。

潘建平教授课题组供稿




