2021年3月31日浙大城市学院医学院潘建平教授团队在病原生物学领域国际顶级期刊PLoS Pathogens在线发表了题为“TcpC inhibits toll-like receptor signaling pathway by serving as an E3 ubiquitin ligase that promotes degradation of myeloid differentiation factor 88”的研究论文。该研究发现尿路致病性大肠埃希菌(uropathogenic E. coli, UPEC)毒力因子TcpC是一种E3泛素连接酶,可以通过促进MyD88泛素化降解,阻断TLR信号通路,抑制巨噬细胞介导的固有免疫功能,揭示了病原菌逃逸机体固有免疫应答的新机制。
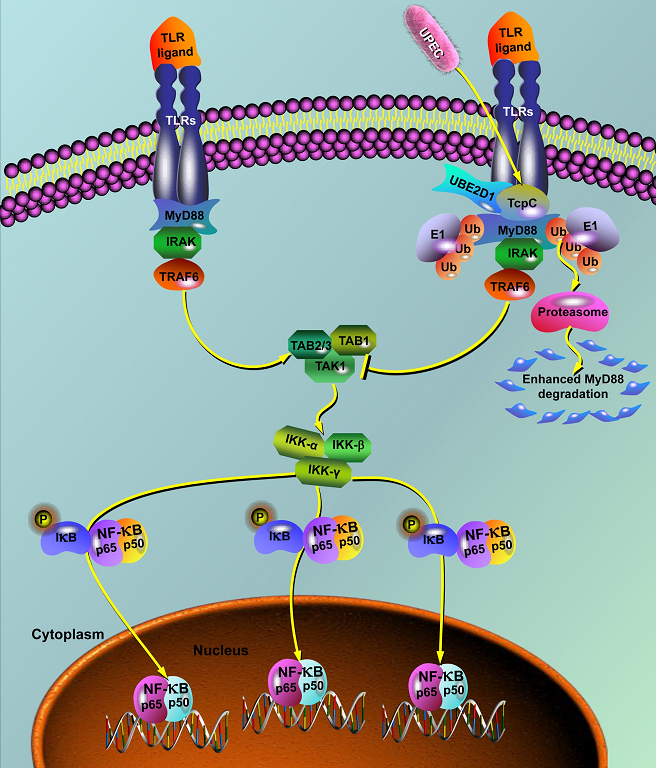
以往研究发现,TcpC因含有TIR结构域,可以直接与TLR竞争结合MyD88,抑制TLR介导的信号途径,从而抑制巨噬细胞的活化和杀菌功能,利于UPEC在体内的存活,与UPEC所致肾盂肾炎等尿路感染的发生、发展密切相关。
本研究发现,在小鼠肾盂肾炎模型中,与敲除tcpc基因的CFT073突变株(CFT073Δtcpc)组相比,分泌TcpC的CFT073野生株(CFT073wt)组肾脏出现明显的脓肿和显著的中性粒细胞浸润(图1A-D);CFT073wt组肾脏巨噬细胞内MyD88蛋白水平显著下降(图1E-F)、胞内MyD88与蛋白酶体标志物(PSMD2)的共定位显著增多(图1G-I)。
图1. 肾盂肾炎模型小鼠肾脏巨噬细胞MyD88水平以及与蛋白酶体共定位情况
作者以人巨噬细胞系THP-1、小鼠巨噬细胞系J774A.1和RAW264.7为细胞模型,研究基因重组TcpC蛋白(rTcpC)对巨噬细胞MyD88表达的影响。结果发现,rTcpC能剂量依赖性地抑制巨噬细胞MyD88蛋白水平,但不影响其mRNA水平,提示TcpC能促进MyD88降解。
泛素化是蛋白质翻译后修饰的重要方式之一,在蛋白质降解、应激反应、细胞周期调节、蛋白质运输、信号转导和转录调节等过程中发挥重要作用。泛素化过程由一个或多个泛素分子在泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3)的共同作用下与其它蛋白质分子共价结合并通常降解这些蛋白质。
作者观察了rTcpC对巨噬细胞MyD88泛素化水平的影响,结果显示,rTcpC处理能显著增强巨噬细胞MyD88泛素化水平。生物信息学分析提示TcpC含有HECT家族E3泛素连接酶所具有的结构特征,而人和小鼠MyD88含有HECT家族E3泛素连接酶底物所具有的P-Y基序,提示TcpC可能是一种新的E3泛素连接酶。随后的体外泛素化实验证明rTcpC是一种能促进MyD88泛素化的E3泛素连接酶。
为了明确与TcpC结合的E2,作者用抗TcpC抗体Pull-down巨噬细胞中能rTcpC结合的蛋白,获得PSM>10的4个条带,经LC-MS/MS分析证实,其中2种蛋白分别是UBE2D1(一种E2)和MyD88。表面等离子共振和等温滴定量热法检测显示,rTcpC能与UBE2D1和MyD88高亲和力结合。
定点突变研究显示,TcpC中C12和W106是维持其E3泛素化连接酶活性的关键位点。
该发现不仅为进一步阐明UPEC的致病性提供了新的实验依据,而且也是病原菌来源的毒力因子作为E3泛素连接酶,促进MyD88泛素化降解,阻断TLR信号通路,从而抑制固有免疫细胞活化的首次报道,为进一步阐明病原菌免疫逃逸机制提供了新的线索,具有重要的学术价值。
图2. TcpC阻断TLR信号通路分子机制示意图
博士后方佳琪、硕士生欧茜和博士生潘鋆为论文的共同第一作者,浙大城市学院医学院潘建平教授、德国海德堡大学Thomas Miethke教授为论文的共同通讯作者。
该研究受到了国家自然科学基金面上项目、浙江省自然科学基金、中国博士后科学基金面上项目的资助。
潘建平教授课题组供稿![]()